Vacina da dengue: a corrida pela imunização que envolve pesquisadores brasileiros, japoneses e americanos
A dengue é endêmica em mais de 120 países, causando 400 milhões de infecções e quase 20 mil mortes a cada ano.
Cerca de 3,9 bilhões de pessoas em todo o mundo - mais da metade da população do planeta - correm o risco de contrair dengue, uma das doenças virais transmitidas por mosquitos que se espalham mais rápido.
Hoje, a dengue é endêmica em mais de 120 países, causando 400 milhões de infecções e quase 20 mil mortes a cada ano.
No Brasil, no ano passado, entre 1º de janeiro e 10 de dezembro, houve 159.718 casos confirmados, com 141 mortes. Para diminuir esses números e evitar uma nova epidemia, como a de 2015, quando houve 1,6 milhão de casos e 972 mortes, instituições públicas de pesquisa e empresas, como o Instituto Butantan, em São Paulo, a companhia japonesa Takeda e a americana Merck Sharp & Dohme (MSD) vêm trabalhando para desenvolver vacinas.
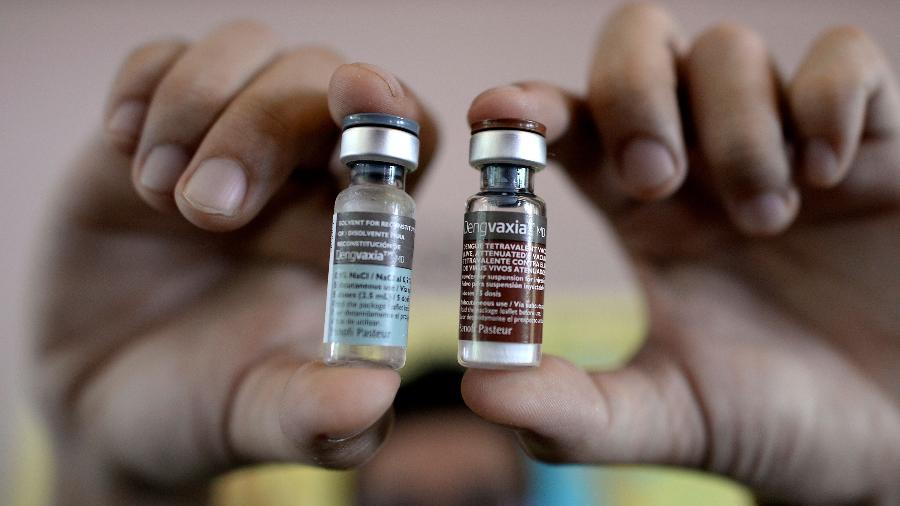
A única já em uso no mundo contra a doença transmitida pelo mosquito Aedes aegypti é a Dengvaxia, produzida por uma multinacional de origem francesa. Indicada para prevenir a dengue causada pelos quatro vírus da dengue (1, 2, 3 e 4), a vacina foi liberado para uso no Brasil pela Agência Nacional de Vigilância Sanitária (Anvisa), em 28 de dezembro de 2015, para pessoas de 9 a 45 anos, residentes em áreas endêmicas. Ela é vendida em clínicas particulares e cada pessoa deve receber três doses, com intervalo de seis meses entre elas.
Posteriormente, estudos do próprio fabricante indicaram que ela apresentava riscos para pessoas que nunca tiveram contato com nenhum dos vírus da dengue. Elas poderiam desenvolver formas mais graves da doença. Por isso, a Anvisa resolveu contraindicar o imunizante para essas pessoas. Antes disso, também pesava contra a Dengvaxia sua relativa baixa eficácia, com média de 66% contra os quatro vírus.
Vírus atenuado
A história do desenvolvimento da nova vacina do Butantan começou em 2007, quando o instituto obteve licença para pesquisar os quatro vírus da dengue. O National Institutes of Health (NIH), a instituição pública de pesquisa em Saúde dos Estados Unidos, havia conseguido atenuá-los geneticamente (deixá-los capaz de provocar uma resposta imune do organismo humano, mas não a doença).
Com eles, os americanos criaram uma espécie de protótipo de imunizante, tetravalente (para os quatro vírus ao mesmo tempo), líquido, que tinha de ser mantido congelado. Foi esta formulação que foi usada para realizar os primeiros testes em seres humanos.
Com a licença obtida, o Butantan trouxe o protótipo para o Brasil e a transformou numa vacina propriamente dita. Também tetravalente, ela é liofilizada, ou seja, em pó, que precisa ser diluída antes de ser aplicada nas pessoas.
"Com isso, ela pode ser mantida em refrigeradores comuns, presentes em qualquer local de vacinação", diz o pesquisador Alexander Roberto Precioso, diretor da Divisão de Ensaios Clínicos e Farmacovigilância do Instituto. "Fizemos testes mostrando que o resultado do nosso produto era equivalente ao da solução americana, o que nos possibilitou pular a fase 1 (testes em animais) e ir direto para a segunda, que verifica a segurança dela em humanos."
Depois de concluída com sucesso a fase 2, o Butantan solicitou à Anvisa, em 2013, aprovação do estudo de fase 3, que foi concedida em 2015. "Nessa etapa, continua o monitoramento da segurança da vacina, mas o objetivo principal é demonstrar a eficácia dela, se realmente ela protege, ou seja, se a reposta imunológica gerada é capaz de imunizar contra os quatro vírus da dengue", explica Precioso.
Após a aprovação na Anvisa, o Instituto começou, em 2016, um estudo que vem sendo feito por 16 centros de pesquisa clínica nas cinco regiões do país, avaliando se a vacina realmente protege contra dengue, em 17 mil voluntários. Eles estão divididos em três faixas etárias: crianças de 2 a 6 anos, um grupo intermediário de 7 a 17, e adultos de 18 a 59. O objetivo é que o produto imunize a população de 2 anos a 59 anos.
Testes finais
Outra vacina que também está passando pela fase três de testes é a TAK-003, desenvolvida pela japonesa Takeda. Segundo seu vice-presidente e chefe do programa global de dengue, Derek Wallace, o produto já passou pelas fases de 1 e 2 com bons resultados.
"Ela induziu respostas imunológicas contra todos os quatro sorotipos de vírus da dengue em diferentes grupos etários, tanto em indivíduos soropositivos [que já foram infectados por um dos vírus] quanto nos soronegativos", diz.
A vacina da Takeda está sendo testada em 20.100 crianças e adolescentes saudáveis (com idades de 4 a 16 anos), em oito países endêmicos, inclusive no Brasil. "Nós esperamos poder analisar os dados de avaliação e publicá-los em uma revista científica revisada por pares ainda no início de 2019", revela Wallace. "Resultados adicionais são esperados a posteriori neste ano, juntamente com os de outros estudos de fase 3."
Se é uma boa notícia que dois imunizantes contra a dengue estejam em estágio avançado de desenvolvimento, a má é que ainda não há prazo definido para elas estarem disponíveis e entrar em programas de vacinação. Na verdade, isso pode demorar um pouco. "Atualmente, nós estamos focados no desenvolvimento clínico do nosso imunizante contra dengue, por isso é prematuro comentar em relação a quando o produto estará disponível", diz Wallace.
A vacina do Butantan também ainda não tem data para estar pronta. Nem o recrutamento dos 17 mil voluntários foi concluído. Ainda faltam cerca 1,5 mil, principalmente crianças de 2 a 6 anos, devido a dificuldade de obtenção de autorização de ambos os pais para que elas possam participar do estudo. O prazo inicial para completar o grupo delas era dezembro de 2018, mais foi prorrogado para junho de 2019. Como cada pessoa que recebe o produto experimental deve ser acompanhada por cinco anos, os testes para esta faixa etária irão até junho de 2024. Para os primeiros que receberam o imunizante, eles terminam em 2021.
O fato de o país estar passando por um período com relativamente poucos casos de dengue poderá, paradoxalmente, atrasar a conclusão dos estudos. "Não é possível afirmar, com certeza, quando a vacina estará disponível na rede pública, pois a demonstração da sua eficácia depende da circulação dos vírus, que tem sido pequena nos últimos anos", explica Precioso. "No entanto, se ela voltar a ser significativa, poderemos mostrar que o imunizante funciona a qualquer momento, pois temos um grande número de voluntários já vacinados."
De acordo com ele, se os casos de dengue aumentarem na população em geral e, nos voluntários, principalmente entre os que receberam placebo - e não a vacina -, o Butantan pode providenciar a documentação necessária e solicitar à Anvisa o registro do produto para aquele grupo etário específico.
Acordo Brasil-EUA
O que também poderá acelerar a disponibilidade da vacina é um acordo, assinado, no dia 12 de dezembro, entre o instituto brasileiro e a MSD. Em 2014, essa empresa obteve licença para usar os mesmos vírus atenuados do NIH, utilizados pelo Butantan, para desenvolver um imunizante para ser comercializada nos Estados Unidos, Canadá, China, Japão, União Europeia e outros países, com exceção do Brasil. Como as pesquisas da MSD começaram depois, os testes dela ainda estão na fase 1.
O acordo estipula que o Butantan repasse para a MSD as informações sobre os testes clínicos que está realizando até que os estudos de ambos os parceiros se nivelem. Depois disso, cada um poderá produzir sua própria vacina. O termo também prevê o licenciamento exclusivo de patentes do produto desenvolvido pelo Butantan para a MSD.
Este item tem mão dupla, se a MSD obtiver patentes do seu próprio imunizante, o instituto brasileiro terá acesso gratuito a elas. Além disso, a empresa americana não poderá comercializar no Brasil a vacina que vier a desenvolver e pagará ao Butantan royalties sobre as vendas dela no exterior.
Por enquanto, como o desenvolvimento de seu imunizante está mais adiantado, o instituto brasileiro receberá da MSD, nessa primeira etapa do acordo, US$ 25 milhões e poderá obter mais US$ 75 milhões, à medida que a empresa norte-americana avance no desenvolvimento e comercialização de seu produto. "O acordo é excelente para o Butantan e para o Brasil", assegura Dimas Tadeu Covas, diretor do Instituto.
"Primeiro, porque demonstra o nível de excelência que os nossos pesquisadores e servidores atingiram no desenvolvimento de uma vacina inédita no mundo. Segundo, porque aponta o caminho que a biotecnologia brasileira deve perseguir: desenvolver produtos e processos inovadores para resolver problemas concretos do país e do mundo."
De acordo com Covas, normalmente a lógica nessa área é o país ser importador de tecnologia. O acordo inverte isso: o Brasil exporta conhecimento. "Além disso, a parceria poderá acelerar o desenvolvimento da vacina, na medida em que o Butantan fornece conhecimentos que impulsionarão o produto da MSD e ao mesmo tempo terá acesso à tecnologia produtiva e experiência da empresa americana, com a possibilidade de testar o imunizante em outros países com epidemiologia diferente da que ocorre no Brasil", diz.
Já assistiu aos nossos novos vídeos no YouTube? Inscreva-se no nosso canal!
https://www.youtube.com/watch?v=iUcaE30wVkA




ID: {{comments.info.id}}
URL: {{comments.info.url}}
Ocorreu um erro ao carregar os comentários.
Por favor, tente novamente mais tarde.
{{comments.total}} Comentário
{{comments.total}} Comentários
Seja o primeiro a comentar
Essa discussão está encerrada
Não é possivel enviar novos comentários.
Essa área é exclusiva para você, assinante, ler e comentar.
Só assinantes do UOL podem comentar
Ainda não é assinante? Assine já.
Se você já é assinante do UOL, faça seu login.
O autor da mensagem, e não o UOL, é o responsável pelo comentário. Reserve um tempo para ler as Regras de Uso para comentários.