Em nova reunião, Anvisa orienta Pfizer sobre pedido emergencial de vacina
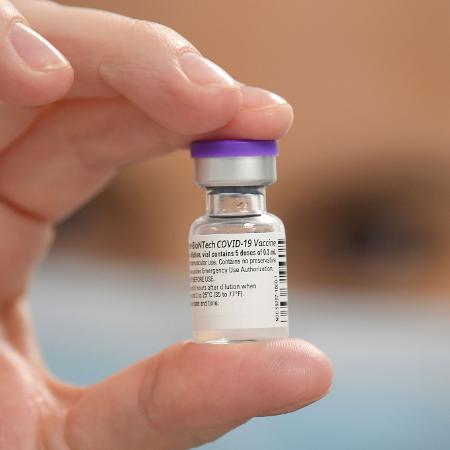
A Anvisa (Agência Nacional de Vigilância Sanitária) realizou hoje uma nova reunião com representantes da Pfizer, empresa que fabrica a vacina produzida em parceria com o laboratório BioNtech e negocia venda de doses do imunizante para o Ministério da Saúde.
Em nota, a agência informou que "no encontro, representantes da Anvisa esclareceram dúvidas e orientaram os representantes da empresa sobre o pedido de uso emergencial para a vacina". A empresa é uma das quatro com testes no Brasil. A reunião foi conduzida por Gustavo Mendes, gerente geral de medicamentos e produtos biológicos da Anvisa.
Na semana passada, o ministro da Saúde, Eduardo Pazuello, pediu condições especiais para comprar as 70 milhões de doses ofertadas ao Brasil pela Pfizer em 15 de agosto. A farmacêutica disse que negocia a venda de vacinas com o Brasil desde junho do ano passado, um mês antes de assinar um acordo confidencial com cláusulas semelhantes às que foram aceitas pela União Europeia e mais 12 países, 6 deles latino-americanos.
As exigências do ministro ocorreram durante o anúncio da compra de 3 milhões de doses da vacina desenvolvida pela Janssen, da Johnson & Johnson.
Até esta terça-feira (12), dois laboratórios pediram autorização para uso emergencial: Butantan, com a CoronaVac, e Fiocruz (Fundação Oswaldo Cruz), com a vacina Oxford/AstraZeneca. O pedido de ambos foi feito na sexta-feira (8), e a Anvisa tem dez dias para analisar o pedido. Segundo a Fiocruz, o pedido de registro da vacina deve ser feito até sexta-feira (15).
Após as análises, se houver reconhecimento de segurança e eficácia da Anvisa, o uso é liberado. Podem ser feitos dois tipos de pedido:
- Pedido de uso emergencial - para ter autorização para imunizar populações específicas: como profissionais de saúde e grupos de risco. Pode ser realizado durante a fase 3 dos estudos da vacina, quando há indícios de que a imunização é eficiente. Prazo para análise é de dez dias;
- Pedido de registro - para ter o registro da vacina em definitivo. Neste caso o medicamento pode ser aplicado em toda a população e comercializado normalmente com bula. Prazo para análise é de 60 dias.
Além disso, há uma lei aprovada ano passado que determina prazo de 72 horas para Anvisa aprovar o registro de fármacos (entre eles vacina) desde que já aprovados em agências regulatórias de referência.
A lei vale para vacinas que estejam registradas (para uso em massa) nas agências dos Estados Unidos, União Europeia, Japão ou da China. Até hoje, nenhuma vacina está aprovada nesta condição em nenhuma dessas agências. A aprovação nestes países é em caráter emergencial.













ID: {{comments.info.id}}
URL: {{comments.info.url}}
Ocorreu um erro ao carregar os comentários.
Por favor, tente novamente mais tarde.
{{comments.total}} Comentário
{{comments.total}} Comentários
Seja o primeiro a comentar
Essa discussão está encerrada
Não é possivel enviar novos comentários.
Essa área é exclusiva para você, assinante, ler e comentar.
Só assinantes do UOL podem comentar
Ainda não é assinante? Assine já.
Se você já é assinante do UOL, faça seu login.
O autor da mensagem, e não o UOL, é o responsável pelo comentário. Reserve um tempo para ler as Regras de Uso para comentários.