Diretores da Anvisa autorizam por unanimidade uso de 2º lote da CoronaVac
Em reunião na tarde de hoje, a diretoria da Anvisa (Agência Nacional de Vigilância Sanitária) aprovou, por unanimidade, o uso emergencial de um segundo lote de doses da CoronaVac, vacina contra o novo coronavírus produzida pelo Instituto Butantan em parceria com o laboratório chinês Sinovac.
Horas depois da decisão, o Butantan informou, no Twitter, que são mais de 4,1 milhões de doses da vacina, uma revisão no número que vinha sendo divulgado, que era mais de 4,8 milhões de doses.
A diretora da Anvisa Meiruze Freitas, relatora do pedido feito pelo Instituto Butantan, foi a primeira a votar favoravelmente à aprovação do novo lote. O voto dela foi seguido pelo diretor-presidente da Anvisa, Antonio Barra Torres, e pelos outros três diretores da agência: Rômison Mota, Alex Machado Campos e Cristiane Gomes.
"A vacina atende aos critérios de qualidade, segurança e eficácia para o uso emergencial", afirmou Freitas ao votar pela aprovação do segundo lote do imunizante.
Antes da votação dos diretores, a Gerência Geral de Medicamentos e a Gerência Geral de Inspeção e Fiscalização Sanitária da Anvisa emitiram parecer favorável pela aprovação da CoronaVac.
A área de medicamentos, entretanto, ponderou que é preciso monitorar incertezas observadas na análise dos estudos do imunizante realizados pelo Instituto Butantan. "A nossa recomendação tem por base o fato de que essa vacina se utiliza dos mesmos estudos clínicos e dos mesmos parâmetros de segurança e eficácia que foram discutidos no domingo", disse o gerente geral de medicamentos da Anvisa, Gustavo Mendes.
A decisão da Anvisa passa a valer a partir do momento em que houver a comunicação oficial ao laboratório, publicado no portal do órgão.
Na segunda-feira (18), o Instituto Butantan solicitou à Anvisa autorização para uso emergencial de um novo lote da CoronaVac, que será envasado no Brasil pelo laboratório.
O segundo lote da CoronaVac será envasado em ampolas que permitem a aplicação de mais de uma dose por frasco —o Butantan informou que a autorização permitirá ao instituto prosseguir com a produção da vacina em seu laboratório, podendo produzir outros 35 milhões de doses.
Até o final de março o Butantan espera disponibilizar, no total, 46 milhões de doses.
Primeiro lote aprovado pela Anvisa
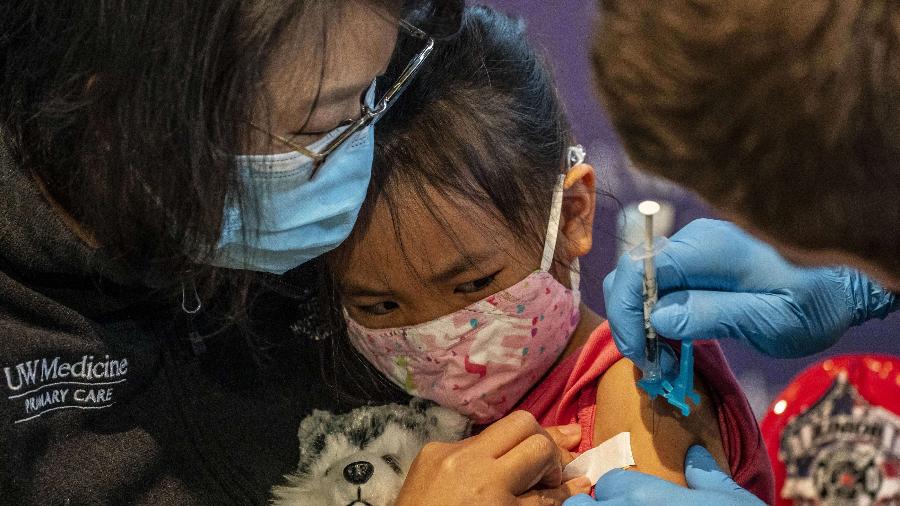
No último domingo (17), a Anvisa aprovou o uso emergencial de um primeiro lote com 6 milhões de doses da CoronaVac que tinha sido importado da China já pronto para aplicação em dose única.
Hoje, a Anvisa aprovou que o Butantan possa importar a vacina a granel e envasar o imunizante em seu laboratório em São Paulo.
O imunizante vem da China, em estado líquido e acondicionado em bolsas para o transporte, e é envasado no Butantan em ampolas de 5 ml que são lacradas e rotuladas pelo instituto. Cada ampola tem capacidade para 10 doses da vacina.
A Anvisa também autorizou hoje que o Butantan possa fazer novas importações de doses prontas ou da vacina a granel, desde que não haja mudanças no processo produtivo nesse último caso.
Os dados de eficácia das vacinas de Oxford e Butantan já foram atestados pela Anvisa e confirmados por órgãos internacionais. Nos testes, nenhum voluntário vacinado adquiriu uma forma grave da covid-19 se contaminado.
As taxas de eficácia dos dois imunizantes são semelhantes às verificadas em vacinas que já fazem parte do PNI, como a da gripe.
A CoronaVac é a única vacina disponível até o momento para uso no Brasil, uma vez que houve atraso para a chegada de 2 milhões de doses da vacina Oxford/AstraZeneca produzidas pela Índia. Previstas para a semana passada, as doses chegaram hoje ao país.
*Com informações de Reuters













ID: {{comments.info.id}}
URL: {{comments.info.url}}
Ocorreu um erro ao carregar os comentários.
Por favor, tente novamente mais tarde.
{{comments.total}} Comentário
{{comments.total}} Comentários
Seja o primeiro a comentar
Essa discussão está encerrada
Não é possivel enviar novos comentários.
Essa área é exclusiva para você, assinante, ler e comentar.
Só assinantes do UOL podem comentar
Ainda não é assinante? Assine já.
Se você já é assinante do UOL, faça seu login.
O autor da mensagem, e não o UOL, é o responsável pelo comentário. Reserve um tempo para ler as Regras de Uso para comentários.