Gestão de Barros na Saúde distribuiu 14 mi de testes de dengue hoje vetados
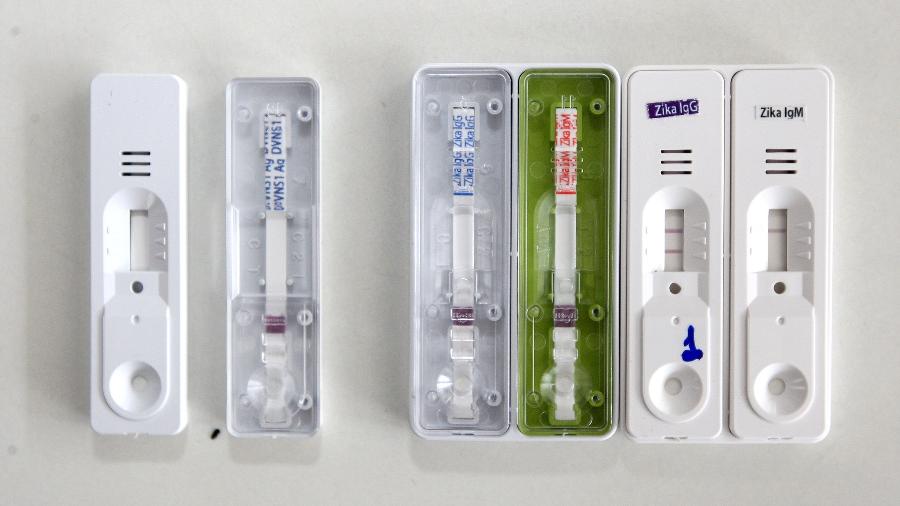
Pelo menos 14 milhões de testes para detecção de dengue, zika e chikungunya distribuídos pelo Ministério da Saúde entre 2016 e 2018 são de lotes cujas amostras foram posteriormente reprovadas em análises do Instituto Nacional de Controle de Qualidade em Saúde (INCQS), da Fiocruz. O prejuízo do governo é de aproximadamente R$ 402 milhões.
A suspeita da ineficácia foi levantada após governos estaduais relatarem que os testes apontavam diagnóstico incorreto, o chamado "falso negativo". A análise do INCQS confirmando que os produtos apresentavam "resultados insatisfatórios" foi realizada em 2018. Os testes começaram a ser recolhidos somente em julho deste ano.
Documentos oficiais mostram que a pasta federal comprou e distribuiu os testes durante a gestão de Ricardo Barros como ministro da Saúde (de 12 de maio de 2016 a 2 de abril de 2018), no governo Michel Temer (MDB). Hoje, Barros (PP-PR) é deputado federal, líder do governo Bolsonaro na Câmara, e está na mira da CPI da Covid.
Procurado pela reportagem, Barros afirmou que a avaliação feita pelo INCQS se refere a lotes utilizados para controle epidemiológico um ano após a sua saída da pasta, que ocupou até abril de 2018.
Em agosto de 2019, uma medida cautelar da Anvisa determinou o recolhimento e vetou o uso desses insumos. Os lotes deveriam ter saído de circulação neste período. Essa decisão se baseou nos laudos do INCQS que apontaram que os testes apresentaram "resultados insatisfatórios".
A responsável pelo desenvolvimento dos produtos é a fundação Bahiafarma, vinculada à gestão do governador Rui Costa (PT). O método de avaliação utilizado pelos técnicos do INCQS é contestado sob a alegação de inconsistências em diversas etapas (leia nota mais abaixo).
De acordo com relatórios de apuração interna da Bahiafarma, os testes eram fabricados pela empresa sul-coreana GenBody Inc. Depois de importados e embalados pelo laboratório baiano, ganhavam registro de produto nacional --o que é considerado ilegal. Um dos documentos descreve que, além de não possuir certificação de boas práticas, a GenBody tampouco foi formalmente qualificada enquanto fornecedora, conforme preconizam as leis que regulam o setor.
Naquela ocasião, o então presidente da Bahiafarma, Ronaldo Dias, refutou o resultado apontado pelo INCQS e ingressou com recurso de efeito suspensivo contra a ordem da Anvisa. Entre os argumentos defendidos pelo laboratório, "nem sequer foi constatado risco de lesão à saúde pública capaz de justificar medida cautelar".
Ronaldo Dias é primo de Roberto Dias, ex-diretor de logística do Ministério da Saúde que, ao fim de seu depoimento na CPI da Covid, em julho passado, recebeu voz de prisão após supostamente mentir aos senadores ante a acusação de pedir propina em negociação de vacinas.
Conforme o UOL apurou, a diretoria do laboratório iniciou o processo de coleta dos testes que ainda estavam armazenados nas secretarias estaduais e municipais de saúde em junho deste ano. Para isso, está licitando a contratação de empresas especializadas nesse tipo de transporte.
Rio de Janeiro, Espírito Santo e Rio Grande do Norte estão entre as unidades da federação que entrarão na logística de devolução dos testes.
Antes da medida cautelar, a Anvisa já havia interditado parcialmente a planta fabril da Bahiafarma, ao apontar que a fundação também não cumpria requisitos mínimos de boas práticas de fabricação. Caso descumprisse as medidas, estaria sujeita a pagar de R$ 2.000 a R$ 1,5 milhão por infração sanitária, além de multa.
Considerando todos os lotes entregues ao Ministério da Saúde dentro do prazo de validade, o passivo da Bahiafarma chegava a mais de R$ 209 milhões, segundo um documento da empresa sobre eventuais riscos financeiros dos contratos.
Bahiafarma nega ineficácia de testes
Procurada pelo UOL, a Bahiafarma negou a existência de irregularidades. "Todos os testes rápidos da Bahiafarma possuem registros sanitários ativos na Anvisa, tendo sido toda a documentação analisada e aprovada pela agência brasileira. Ainda, a fabricação destes produtos, entre os anos 2016 e 2018, se deu sob condições de Boas Práticas de Fabricação e Controle de Qualidade, conforme Resoluções da Anvisa", informa a nota encaminhada pela assessoria da Sesab (Secretaria Estadual de Saúde).
De acordo com o laboratório, as análises nos testes reprovados foram feitas a partir de amostras que não estavam armazenadas no almoxarifado da Bahiafarma.
"Segundo conclusão dos laudos assinados pelo INCQS, sete destes lotes apresentaram sensibilidade ou especificidade abaixo dos valores que estavam declarados nas respectivas instruções de uso elaboradas pela Bahiafarma. Baseada neste laudo, a Anvisa decidiu, por meio da RE 2.096/2019, determinar o recolhimento dos produtos do mercado".
Para a fundação, a análise executada pelo INCQS também não obedeceu a qualquer tratamento estatístico, o que teria gerado equívoco na sua conclusão, conforme demonstra um parecer estatístico que foi levado à Anvisa.
"Este estudo foi devidamente apresentado à Anvisa, no qual se evidenciou que a conclusão a que deveria chegar o INCQS, baseado nos resultados por ele obtidos, é a de satisfatoriedade para todos os parâmetros dos testes de zika e dengue, e de satisfatoriedade para o parâmetro de especificidade dos testes de chikungunya."
A fundação acrescenta que continua a apresentar esclarecimentos técnicos no âmbito do processo administrativo em julgamento na Anvisa.

Barros diz desconhecer irregularidades
Ministro da Saúde na época da compra, Ricardo Barros afirmou desconhecer os questionamentos acerca da qualidade dos testes rápidos. Disse, ainda, que os supostos problemas relatados pela reportagem foram identificados depois de ter deixado o cargo, em abril de 2018.
"As análises de segurança e qualidade do produto são atribuições respectivamente da Anvisa e do INCQS. O processo de aquisição foi realizado pelo departamento responsável do Ministério da Saúde, respeitando a legislação e as normas técnicas. Os questionamentos foram feitos ao longo da execução do contrato, o que também é pertinente ao processo sanitário", explicou, via assessoria.
Indagado acerca dos valores aplicados na compra dos produtos no período de sua gestão, Barros disse não ter essa informação. Seu sucessor no posto, Luiz Henrique Mandetta afirmou que pediria o reembolso dos recursos usados para a compra dos produtos reprovados, conforme informou o jornal O Estado de S. Paulo à época. O UOL, porém, não conseguiu contatá-lo.
Também em nota, o Ministério da Saúde informou que a distribuição dos testes rápidos para as arboviroses foi descontinuada em julho de 2019, quando a Anvisa cancelou o certificado de boas práticas de fabricação da Bahiafarma e determinou a suspensão, fabricação, circulação e uso dos insumos. A pasta não respondeu se busca ressarcimento dos valores destinados aos produtos reprovados.
Ao UOL a Anvisa disse que os recursos administrativos interpostos pela Bahiafarma ainda estão sendo analisados por sua diretoria. Afirmou que, além das alegações "infundadas" da Bahiafarma, a manutenção da utilização do produto até o julgamento do caso incorreria em risco sanitário. "A fundação já foi informada da necessidade de cumprir as ações de recolhimento enquanto a diretoria da Anvisa não aprecia os recursos em última instância."
O UOL não conseguiu localizar representantes da sul-coreana GenBody, nem Ronaldo Dias, ex-diretor da Bahiafarma.













ID: {{comments.info.id}}
URL: {{comments.info.url}}
Ocorreu um erro ao carregar os comentários.
Por favor, tente novamente mais tarde.
{{comments.total}} Comentário
{{comments.total}} Comentários
Seja o primeiro a comentar
Essa discussão está encerrada
Não é possivel enviar novos comentários.
Essa área é exclusiva para você, assinante, ler e comentar.
Só assinantes do UOL podem comentar
Ainda não é assinante? Assine já.
Se você já é assinante do UOL, faça seu login.
O autor da mensagem, e não o UOL, é o responsável pelo comentário. Reserve um tempo para ler as Regras de Uso para comentários.