Pfizer cita possíveis mudanças da Anvisa e volta a cogitar uso emergencial
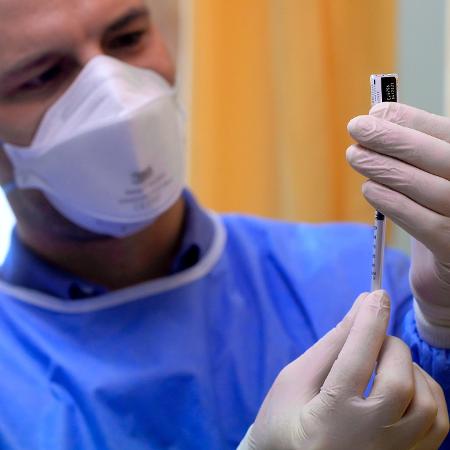
A farmacêutica americana Pfizer afirmou hoje, após nova reunião com a Agência Nacional de Vigilância Sanitária (Anvisa), que voltou a cogitar a solicitação para o uso emergencial da sua vacina contra a covid-19 no Brasil. A empresa tinha afirmado na última segunda-feira (28) que iria submeter o imunizante apenas para a chamada submissão contínua.
O argumento da Pfizer, no início da semana, era que tinha "esbarrado em dificuldades" do Guia de Submissão para Uso Emergencial, elaborado pela própria agência brasileira.
Porém, hoje, com novos esclarecimentos da Anvisa, o laboratório declarou que há a possibilidade da agência "modular" pontos específicos do guia de submissão, possibilitando maior agilidade na submissão deste tipo de processo.
"Uma nova reunião técnica será realizada e, com base nessa discussão adicional e no andamento das negociações com o Governo Brasileiro, a Pfizer irá avaliar a possibilidade de solicitar o uso emergencial", disse a empresa, em comunicado.
"Em paralelo, a companhia continuará dando andamento ao processo de submissão contínua junto à Agência, em busca de uma rápida aprovação do registro de sua vacina", acrescentou.
Ontem, o Ministério da Saúde rebateu as declarações anteriores da Pfizer, apontando que as exigências da Anvisa com relação à autorização para uso emergencial são as mesmas da FDA (Food and Drug Administration), agência federal do departamento de Saúde e Serviços Humanos dos Estados Unidos.
"Causou espécie porque esses laboratórios já têm autorização pela FDA e de outras agências pelo mundo. Vamos buscar maior diálogo com o laboratório. Temos incentivado porque na solicitação para uso emergencial ela é designada para grupos específicos", disse o secretário-executivo da pasta, Elcio Franco.
Mais cedo, a Anvisa informou que a Fiocruz (Fundação Oswaldo Cruz), laboratório brasileiro parceiro da AstraZeneca — responsável pela vacina de Oxford —, irá pedir autorização para o uso emergencial do imunizante contra a covid-19 no Brasil, mas não disse quando isso acontecerá.
Até agora, a Fundação havia informado apenas que pediria o registro definitivo - hoje, a presidente da Fiocruz, Nísia Trindade, disse que esse pedido será feito até o próximo dia 15 de janeiro. A data já havia sido antecipada à Folha de S.Paulo pelo vice-presidente da fundação, Marco Krieger.
Leia abaixo a nota completa da Pfizer:
Em relação a reunião realizada entre a Pfizer e a ANVISA hoje, dia 30 de dezembro, a companhia esclarece:
- Pfizer e ANVISA realizaram hoje uma positiva reunião para tratar de pontos relacionados ao processo de submissão de uso emergencial e submissão contínua de vacinas contra a COVID-19.
- Ao longo do encontro, e diante dos esclarecimentos feitos pela Agência, a empresa entendeu que há a possibilidade de a ANVISA modular pontos específicos do Guia de Submissão para Uso Emergencial, possibilitando uma maior agilidade na submissão desse tipo de processo.
- Uma nova reunião técnica será realizada e, com base nessa discussão adicional e no andamento das negociações com o Governo Brasileiro, a Pfizer irá avaliar a possibilidade de solicitar o uso emergencial.
- Em paralelo, a companhia continuará dando andamento ao processo de submissão contínua junto à Agência, em busca de uma rápida aprovação do registro de sua vacina.
Anvisa muda regras para aprovação emergencial
A Anvisa atualizou ontem o guia de uso emergencial de vacinas contra a covid-19. O documento trata dos requisitos mínimos para submeter a solicitação de autorização temporária para aplicar o imunizante no Brasil.
O órgão regulador alterou dois itens do guia. Em um deles, retirou a obrigatoriedade de a empresa fornecer um cronograma de disponibilização da vacina ao País. Também não é mais necessário informar a quantidade de produto disponível, mas apenas uma previsão
Outro ponto modificado pela Anvisa trata do TCLE (Termo de Consentimento Livre e Esclarecido) que o paciente vacinado deve assinar. No novo texto, o governo sugere que seja utilizado o modelo adotado pelo Reino Unido ou outro desenvolvido pela empresa.














ID: {{comments.info.id}}
URL: {{comments.info.url}}
Ocorreu um erro ao carregar os comentários.
Por favor, tente novamente mais tarde.
{{comments.total}} Comentário
{{comments.total}} Comentários
Seja o primeiro a comentar
Essa discussão está encerrada
Não é possivel enviar novos comentários.
Essa área é exclusiva para você, assinante, ler e comentar.
Só assinantes do UOL podem comentar
Ainda não é assinante? Assine já.
Se você já é assinante do UOL, faça seu login.
O autor da mensagem, e não o UOL, é o responsável pelo comentário. Reserve um tempo para ler as Regras de Uso para comentários.