Entenda passo a passo para aprovação de vacinas de covid-19 na Anvisa
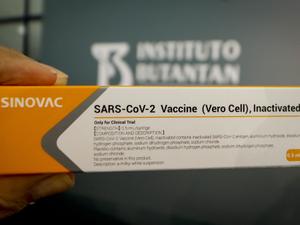
O governador de São Paulo, João Doria (PSDB-SP), e sua equipe da Saúde apresentaram hoje (7) resultados de 78% de eficácia da vacina CoronaVac, desenvolvida pelo Instituto Butantan em parceria com o laboratório chinês Sinovac.
No entanto, o Butantan ainda não fez o pedido de permissão para aplicação das doses à Anvisa (Agência de Vigilância Sanitária) — seria a primeira solicitação de uso de um imunizante contra covid-19 encaminhada ao órgão.
A expectativa é que essa demanda aconteça entre hoje ou amanhã. A Fiocruz (Fundação Oswaldo Cruz) também deve divulgar hoje os dados de composição e fabricação de sua vacina desenvolvida em parceria com a Universidade de Oxford e o laboratório AstraZeneca, ambos do Reino Unido. Com isso, também devem pedir até amanhã autorização para uso emergencial.
Entenda, a seguir, o passo a passo para liberação de vacinas contra o novo coronavírus no Brasil.
Pesquisas
Primeiro, os laboratórios realizam pesquisas pré-clínicas para conhecer o comportamento do vírus. A seguir vêm os estudos com testes em humanos, são três fases clínicas:
Fase 1 - avalia a segurança e possíveis reações indesejáveis da aplicação da vacina. Nessa fase verifica-se de forma preliminar a capacidade de gerar anticorpos contra o novo coronavírus. São poucos voluntários, cerca de 100.
Fase 2 - avalia a dosagem, a forma de vacinação com componentes mais adequados e a capacidade de gerar anticorpos (contra o novo coronavírus) na população que deverá ser indicada para receber a vacina. O grupo em estudo é maior do que na Fase 1, geralmente algumas centenas de pessoas.
Fase 3 - os testes nessa etapa são realizadas em grandes populações para avaliar a segurança e a eficácia da vacina. A vacina precisa provar que, de fato, é capaz de nos proteger da doença. Mesmo ao término desta fase, as reações adversas continuam sendo monitoradas.
Documentação
Os laboratórios juntam os documentos técnicos que permitam à Anvisa verificar os dados de segurança e eficácia, e a qualidade da vacina. Esses dados devem conter informações de estudos clínicos e não clínicos e informações de tecnologia farmacêutica (referentes à qualidade, ao processo de fabricação e ao controle de qualidade), por exemplo.
É necessário também apontar dados sobre as matérias-primas utilizadas no desenvolvimento do produto.
Pedido e autorização
Se ficar comprovada a eficácia superior a 50% da vacina, a empresa pode solicitar o registro permanente da vacina. Para este tipo de autorização é necessário que os desenvolvedores indiquem que há pesquisas pós-comercialização sobre monitoramento de reações adversas não detectadas em estudos.
Após as análises, se houver reconhecimento de segurança e eficácia da Anvisa, o uso é liberado. Podem ser feitos dois tipo de pedido:
- Pedido de uso emergencial - para ter autorização para imunizar populações específicas: como profissionais de saúde e grupos de risco. Pode ser realizado durante a fase 3 dos estudos da vacina, quando há indícios de que a imunização é eficiente. Prazo para análise é de 10 dias.
- Pedido de registro - para ter o registro da vacina em definitivo. Neste caso o medicamento pode ser aplicado em toda a população e comercializado normalmente com bula. Prazo para análise é de 60 dias
Reuniões entre Anvisa e laboratórios
As reuniões que Butantan e Fiocruz realizam com a Anvisa nesta semana são as últimas etapas para conferência de documentação e apresentação de eficácia antes do pedido de uso emergencial ou de registro. Na prática, é como se fosse feita uma checagem de todos os documentos para identificar se estão corretos e nos moldes adequados para depois serem submetidos a analisados pela Anvisa.
O país registrou 199.043 mortes em decorrência da doença e soma 7,8 milhões de infectados. Os dados foram divulgados ontem pelo consórcio de veículos de imprensa, do qual o UOL faz parte.












ID: {{comments.info.id}}
URL: {{comments.info.url}}
Ocorreu um erro ao carregar os comentários.
Por favor, tente novamente mais tarde.
{{comments.total}} Comentário
{{comments.total}} Comentários
Seja o primeiro a comentar
Essa discussão está encerrada
Não é possivel enviar novos comentários.
Essa área é exclusiva para você, assinante, ler e comentar.
Só assinantes do UOL podem comentar
Ainda não é assinante? Assine já.
Se você já é assinante do UOL, faça seu login.
O autor da mensagem, e não o UOL, é o responsável pelo comentário. Reserve um tempo para ler as Regras de Uso para comentários.