Moderna pede autorização para uso emergencial de vacina da covid-19 nos EUA
A Moderna anunciou ter protocolado na FDA (Administração de Alimentos e Medicamentos, na sigla em inglês) um pedido formal para uso emergencial da vacina contra o coronavírus nos Estados Unidos. Segundo a farmacêutica, os dados dos estudos clínicos foram enviados para a análise do órgão, que irá decidir se o imunizante pode ser aplicado na população.
Mais cedo, a empresa havia informado que sua vacina teve 94,1% de eficácia nos estudos de fase 3: dos 196 voluntários que tiveram covid-19, 185 deles receberam o placebo, enquanto 11 receberam o imunizante ativo. A vacina também tem 100% de sucesso na prevenção de casos graves da doença, uma vez que os vacinados infectados tiveram apenas sintomas leves.
A eficácia ainda foi consistente em todos os grupos de idade, bem como raça e etnia. Os 196 participantes com covid-19 incluíram 33 adultos com mais de 65 anos, e 42 que se identificaram como hispânicos, negros, asiático-americanos ou multirraciais.
Antes da fase 3, a vacina Moderna, chamada mRNA-1273, também se mostrou segura. Até agora, o imunizante só causou efeitos colaterais leves na maioria dos receptores, geralmente febre e dores que duraram um ou dois dias.
A Moderna, que também planeja buscar aprovação na Europa, deve ser a segunda empresa a fazer o pedido para uso emergencial da vacina nos EUA. A primeira foi a Pfizer, na semana passada, que deu início aos trâmites também no Reino Unido, onde a vacinação deve começar já na semana que vem.
Os norte-americanos marcaram para o próximo dia 10 o anúncio final da avaliação da vacina da Pfizer. Já a análise da vacina da Moderna deve ser apresentada pela FDA na semana seguinte, em 17 de dezembro.
O presidente da Moderna, Stephen Hoge, destacou a velocidade na produção da vacina, com dados "realmente empolgantes". Agora, a farmacêutica precisará fabricar o número prometido de doses: só para os EUA são 20 milhões no próximo mês e pelo menos 80 milhões a mais no próximo ano.
Perspectivas para o Brasil
O Brasil ainda não comprou doses da vacina da Moderna, mas representantes da empresa se reuniram recentemente com o Ministério da Saúde para tratar do tema. O governo federal tem um acordo prévio apenas com a AstraZeneca, que desenvolve uma vacina em parceria com a Universidade de Oxford.
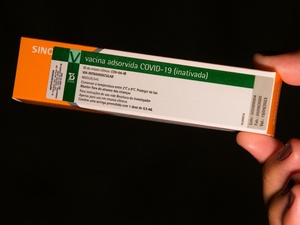
No estado de São Paulo, o governador João Doria (PSDB) fez acordo com a farmacêutica SinoVac Life Science e promete 46 milhões de doses da CoronaVac, como é chamada, nos próximos meses. O imunizante também está na fase 3 de testes.
(Com Estadão Conteúdo e Reuters)














ID: {{comments.info.id}}
URL: {{comments.info.url}}
Ocorreu um erro ao carregar os comentários.
Por favor, tente novamente mais tarde.
{{comments.total}} Comentário
{{comments.total}} Comentários
Seja o primeiro a comentar
Essa discussão está encerrada
Não é possivel enviar novos comentários.
Essa área é exclusiva para você, assinante, ler e comentar.
Só assinantes do UOL podem comentar
Ainda não é assinante? Assine já.
Se você já é assinante do UOL, faça seu login.
O autor da mensagem, e não o UOL, é o responsável pelo comentário. Reserve um tempo para ler as Regras de Uso para comentários.