Após Índia vetar exportação da vacina AstraZeneca, Itamaraty negocia acordo
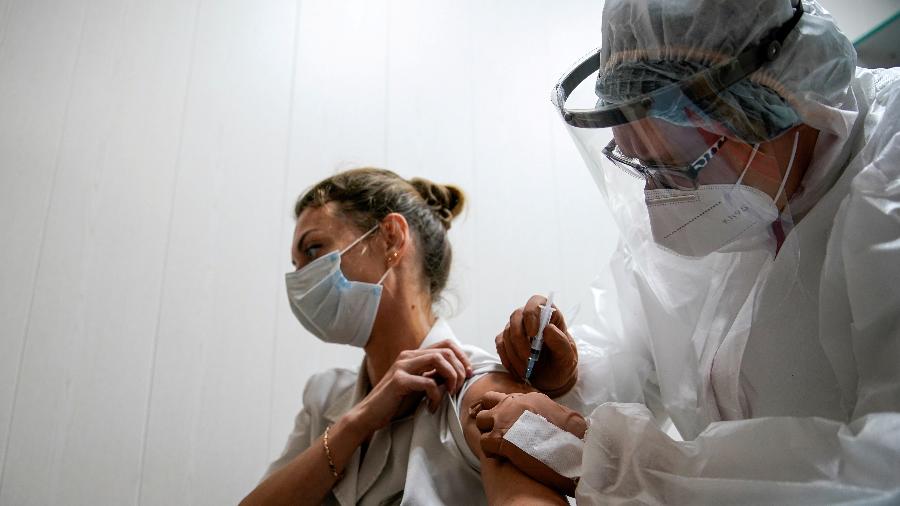
Após a notícia de que a Índia vai proibir a exportação de doses da vacina contra a covid-19 desenvolvida pela farmacêutica AstraZeneca em parceria com a Universidade de Oxford, a Fiocruz (Fundação Oswaldo Cruz) afirmou hoje que o Ministério das Relações Exteriores está à frente das negociações para importar doses prontas da vacina da Índia.
No último sábado, o Instituto Serum, fabricante indiano contratado para produzir 1 bilhão de doses da vacina AstraZeneca para países em desenvolvimento, informou que o governo vai vetar a exportação de doses da vacina. O imunizante não poderá ser vendido por cerca de três meses, no mínimo.
Segundo o presidente do Instituto Serum, Adar Poonawalla, a proibição de venda internacional foi uma das condições para que a AstraZeneca recebesse autorização de emergência na Índia —assim, o governo quer garantir ao menos 100 milhões de doses para vacinar os grupos prioritários.
O plano da Fiocruz é conseguir a importação de 2 milhões de doses prontas da vacina AstraZeneca da Índia, o que permitiria antecipar para janeiro o calendário de imunização no Brasil.
O laboratório brasileiro também quer produzir doses, mas o primeiro lote deve ficar pronto apenas em fevereiro.
Anvisa se reúne com empresa de outro imunizante
Na noite de hoje, a Anvisa (Agência Nacional de Vigilância Sanitária) divulgou que fez uma reunião com integrantes da Precisa Farmacêutica Ltda, que representa no Brasil a empresa Bharat Biotech, farmacêutica responsável por outro imunizante aprovado na Índia contra a covid-19. No encontro, foram explicadas as regras para aprovação da vacina no país.
De acordo com a agência, a empresa ainda não tem um planejamento definido. "Durante a reunião, a empresa esclareceu que ainda vai definir a estratégia para o Brasil, sendo possível a condução de estudos clínicos fase III ou a solicitação de registro definitivo de forma direta", explicou.
A Anvisa explicou ainda que a vacina desenvolvida pela Bharat Biotech não tem testes realizados no Brasil, condição necessária para aprovação do uso emergencial da vacina. Sem isso, a aprovação só pode ser solicitada para uso definitivo, o que também não ocorreu ainda, de acordo com a agência.














ID: {{comments.info.id}}
URL: {{comments.info.url}}
Ocorreu um erro ao carregar os comentários.
Por favor, tente novamente mais tarde.
{{comments.total}} Comentário
{{comments.total}} Comentários
Seja o primeiro a comentar
Essa discussão está encerrada
Não é possivel enviar novos comentários.
Essa área é exclusiva para você, assinante, ler e comentar.
Só assinantes do UOL podem comentar
Ainda não é assinante? Assine já.
Se você já é assinante do UOL, faça seu login.
O autor da mensagem, e não o UOL, é o responsável pelo comentário. Reserve um tempo para ler as Regras de Uso para comentários.