Fiocruz pede registro definitivo da vacina de Oxford à Anvisa
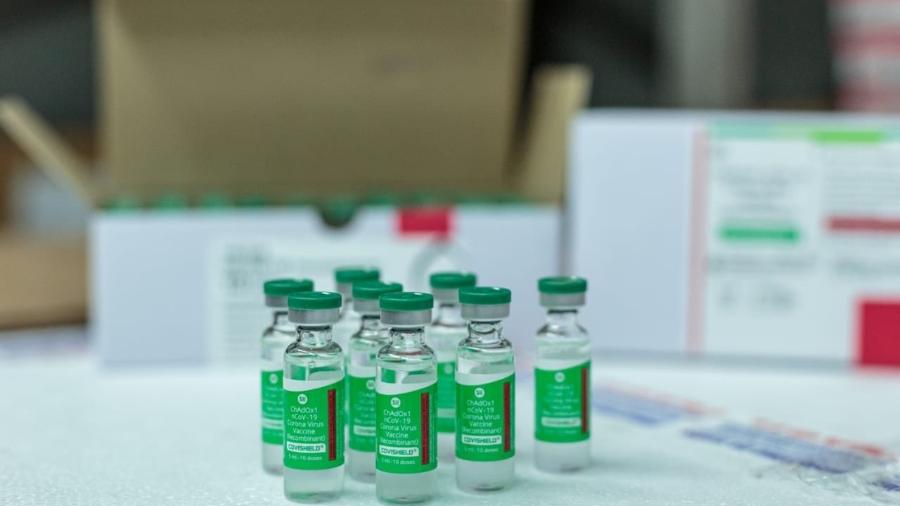
A Fiocruz (Fundação Oswaldo Cruz) entrou hoje com o pedido de registro definitivo da vacina Covishield, produzida pela Universidade de Oxford em parceria com o laboratório AstraZeneca. O imunizante já está aprovado pela Anvisa (Agência Nacional de Vigilância Sanitária) para uso emergencial no Brasil.
O registro é a autorização para que o imunizante seja utilizado de forma permanente e em toda a população brasileira. O uso emergencial dos 2 milhões de doses importados da Índia permite apenas a aplicação em grupos específicos de pessoas, como profissionais de saúde e idosos.
"Este é mais um passo fundamental no enfrentamento à pandemia e dará à população brasileira um amplo acesso à vacina, que será distribuída pelo Programa Nacional de Imunização (PNI) do Ministério da Saúde", disse a presidente da Fiocruz, Nísia Trindade Lima, em entrevista ao site da fundação.
A Anvisa tem 60 dias para analisar. No entanto, internamente, a expectativa é que isso leve menos tempo, pois um primeiro lote de 2 milhões de doses da Covishield já recebeu autorização para uso emergencial.
"Devido ao estágio das avaliações já realizadas, buscando superar os prazos legais estabelecidos, a Anvisa manterá total prioridade na análise para fins de concluir o processo no menor tempo possível", informou a agência em seu site oficial, confirmando o recebimento do pedido feito pela Fiocruz. "A Agência vem buscando a superação dos prazos para favorecer o acesso e apoiar as ações para o enfrentamento dessa emergência da saúde pública."
100 milhões de doses até julho de 2021
A Fiocruz espera atingir a marca de 100,4 milhões de doses produzidas até julho de 2021, a partir da chegada do Ingrediente Farmacêutico Ativo (IFA). A Fundação afirmou que, a partir do segundo semestre com a transferência de tecnologia, o IFA começará a ser produzido no Brasil, o que deve garantir a autonomia do desenvolvimento das doses do imunizante da Oxford na própria Fiocruz, acelerando o processo de produção da vacina aqui.
"Essa submissão é diferente da autorização para uso emergencial que obtivemos recentemente. O uso emergencial foi concedido especificamente para os 2 milhões de doses que foram adquiridos e importados do Instituto Serum, na Índia, em caráter emergencial e temporário. Agora, com a entrega desse último pacote de informações, visamos a autorização definitiva para a produção e fornecimento da vacina", explicou a vice-diretora de Qualidade de do Instituto de Tecnologia em Imunobiológicos (Bio-Manguinhos/Fiocruz), Rosane Cuber.
Expectativa pelo pedido do Butantan
A Fiocruz tem enviado vários documentos em partes há algumas semanas para apressar a análise na Anvisa. O Instituto Butantan tem tomado a mesma atitude.
Por isso, há a expectativa de que também haja em breve um pedido de registro da vacina CoronaVac. Ela é fabricada no Brasil em parceria com o laborário Sinovac. O UOL questionou o Instituto Butantan se haverá pedido de registro da vacina CoronaVac hoje, mas ainda não obteve resposta.
No Brasil, existem quatro vacinas em análise na Anvisa:
- CoronaVac: produzida por Butantan e Sinovac, tem autorização de uso emergencial para pouco mais de 10 milhões de doses. Ainda não fez pedido de registro;
- Covishield: produzida pela Fiocruz, Oxford e AstraZeneca, tem autorização de uso emergencial para 2 milhões de doses. Acaba de fazer pedido de registro;
- Vacina da Pfizer: produzida pelos laboratórios Pfizer e BioNTech, tem sido usada de maneira emergencial em países como Inglaterra, EUA e Chile. No Brasil, a empresa ainda não pediu o uso emergencial ou registro. No entanto, tem apresentado documentos aos poucos à Anvisa. A empresa obteve certificado de boas práticas de fabricação;
- Vacina da Janssen: produzida pelo laboratório Janssen. No Brasil, a empresa ainda não pediu o uso emergencial ou registro. No entanto, tem apresentado documentos aos poucos à Anvisa. A empresa obteve certificado de boas práticas de fabricação.
Uma quinta vacina, a Sputnik V, pode ser usada no Brasil. Ela foi desenvolvida na Rússia e é utilizada na Argentina. Mas a Anvisa não aceitou a documentação enviada pela empresa brasileira União Química, parceira dos russos na transferência de tecnologia, para iniciar as análises. As negociações e reuniões continuam, porém.
















Seja o primeiro a comentar
Essa área é exclusiva para você, assinante, ler e comentar.
O autor da mensagem, e não o UOL, é o responsável pelo comentário. Reserve um tempo para ler as Regras de Uso para comentários.