Anvisa recebe pedido de registro definitivo da vacina da Pfizer
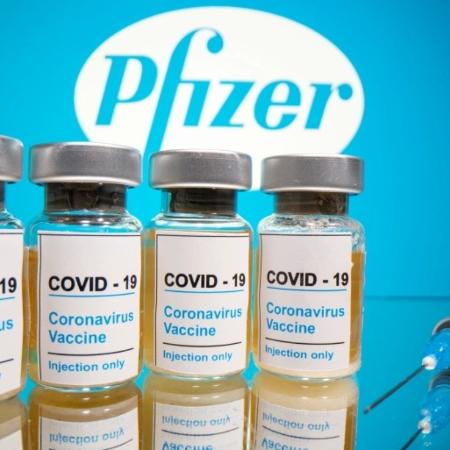
O laboratório americano Pfizer enviou hoje à Anvisa (Agência Nacional de Vigilância Sanitária) o pedido de registro definitivo da vacina contra covid-19, chamada de "Cominarty", desenvolvida em parceria com a farmacêutica alemã BioNTech.
Este é o segundo pedido do gênero recebido pela agência — o primeiro foi feito no dia 29 de janeiro pela Fiocruz (Fundação Oswaldo Cruz) para a vacina produzida pela Universidade de Oxford em parceria com o laboratório AstraZeneca.
O registro é a autorização para que o imunizante seja utilizado de forma permanente e em toda a população brasileira. A Anvisa tem 60 dias para analisar.
"Quando for aprovado e for concedido pela Anvisa, o registro é o sinal verde para que a vacina seja comercializada, distribuída e utilizada pela população, nos termos da indicação estabelecida na bula. Ou seja, o registro é a avaliação completa com dados mais robustos dos estudos de qualidade, eficácia e segurança, bem como do plano de mitigação dos riscos e da adoção das medidas de monitoramento", informou a Anvisa em comunicado divulgado em seu site.
Apesar de só ter feito o pedido de registro hoje, a empresa já vinha apresentando documentos à Anvisa. No fim de dezembro, a agência informou que as quatro empresas envolvidas no desenvolvimento do imunizante receberam o certificado de boas práticas de fabricação. A certificação é um dos pré-requisitos para o processo de registro do imunizante.
Cristiano Zerbini, coordenador dos testes da vacina no Brasil, comemorou a notícia da apresentação do pedido. "É uma vacina excelente (...) Estou torcendo para que haja um acordo entre o Ministério da Saúde e a Pfizer para que a gente tenha disponível para todos os brasileiros", disse em entrevista à CNN.
Negociação complicada
As negociações do governo brasileiro com a Pfizer tiveram início em junho do ano passado, cerca de dois meses antes de a farmacêutica fazer uma proposta para oferecer 70 milhões de doses a partir de dezembro. Mas as tratativas não avançaram e o país perdeu lugar na fila, mesmo tendo sido alertado pela empresa sobre a alta demanda.
No dia 23 de janeiro, o governo federal confirmou em nota ter recebido uma nova oferta de vacinas pela Pfizer, mas descartou a negociação por considerar a quantidade proposta — 2 milhões de doses — muito baixa, o que, segundo Ministério da Saúde, "causaria frustração a todos os brasileiros".
O número, porém, é igual ao de doses da vacina AstraZeneca/Oxford importadas da Índia pela Fiocruz, que chegaram ao país um dia antes.
"Apesar de todo o poder midiático promovido pelo laboratório, as doses iniciais oferecidas ao Brasil seriam mais uma conquista de marketing, branding e growth para a produtora de vacina, como já vem acontecendo em outros países. Já para o Brasil, causaria frustração em todos os brasileiros, pois teríamos, com poucas doses, que escolher, num país continental com mais de 212 milhões de habitantes, quem seriam os eleitos a receberem a vacina", diz um trecho do comunicado.
O governo contrariou órgãos técnicos e excluiu trecho da MP (Medida Provisória), publicada em 6 de janeiro, que poderia ter facilitado a compra da vacina.
Vacina de RNA mensageiro
A vacina utiliza a tecnologia chamada de mRNA ou RNA-mensageiro, diferente da CoronaVac ou da AstraZenca/Oxford, que utilizam o cultivo do vírus em laboratório. Os imunizantes são criados a partir da replicação de sequências de RNA por meio de engenharia genética, o que torna o processo mais barato e mais rápido.
O RNA mensageiro mimetiza a proteína spike, específica do vírus Sars-CoV-2, que o auxilia a invadir as células humanas. Essa "cópia", no entanto, não é nociva como o vírus, mas é suficiente para desencadear uma reação das células do sistema imunológico, que cria uma defesa robusta no organismo. O imunizante da Pfizer precisa ser estocado a -75ºC — um dos grandes desafios para os países.
Em novembro, a Pfizer anunciou que a vacina é segura e tem 95% de eficácia. Essa é a conclusão final da terceira fase de testes.
A vacina foi testada em 43,5 mil pessoas de seis países e, em setembro, a Anvisa autorizou que seus testes clínicos fossem ampliados no Brasil, de mil para dois mil testes em voluntários. Os testes foram feitos em São Paulo e Bahia.















ID: {{comments.info.id}}
URL: {{comments.info.url}}
Ocorreu um erro ao carregar os comentários.
Por favor, tente novamente mais tarde.
{{comments.total}} Comentário
{{comments.total}} Comentários
Seja o primeiro a comentar
Essa discussão está encerrada
Não é possivel enviar novos comentários.
Essa área é exclusiva para você, assinante, ler e comentar.
Só assinantes do UOL podem comentar
Ainda não é assinante? Assine já.
Se você já é assinante do UOL, faça seu login.
O autor da mensagem, e não o UOL, é o responsável pelo comentário. Reserve um tempo para ler as Regras de Uso para comentários.