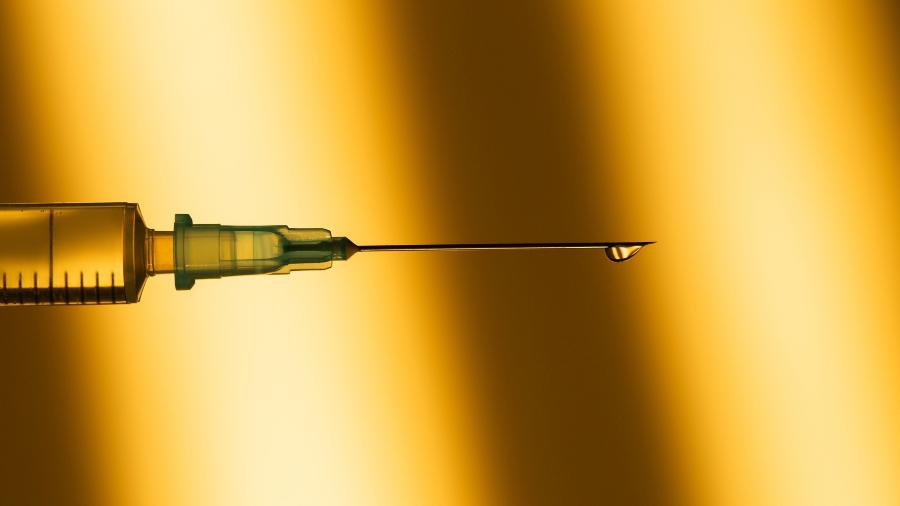
Vacina pode chegar ao Brasil até março, diz presidente da Pfizer no país

O presidente da Pfizer no Brasil, Carlos Murillo, disse hoje que trabalha com a previsão de que a vacina contra a covid-19 da farmacêutica americana esteja à disposição no país até março do ano que vem. Ao participar de um simpósio online promovido pela Academia Nacional de Medicina, Murillo adiantou que 50 milhões de doses do imunizante estarão disponíveis já neste ano, e o total para o ano que vem chega a 1,3 bilhão de doses para todo o mundo.
"No caso do Brasil, ainda estamos trabalhando fortemente com o governo brasileiro para tentar acelerar a disponibilidade o mais rápido possível. Tenho esperança de que no primeiro trimestre do próximo ano poderíamos estar contando com essa vacina disponível no Brasil", disse Murillo, explicando que a empresa e o governo ainda estão em negociação. Nesta semana, o Ministério da Saúde afirmou que analisa a compra do imunizante.
Nos Estados Unidos, a Pfizer espera obter o registro de sua vacina na Food and Drug Administration (FDA, agência do Departamento de Saúde dos Estados Unidos) em dezembro, o que permitiria iniciar a vacinação no país ainda neste ano.
A previsão da farmacêutica, que desenvolve a vacina em parceria com o laboratório alemão Biontech, é de que os requisitos exigidos pela agência reguladora americana para completar a solicitação de registro devem ser cumpridos na terceira semana de novembro. A partir daí, a avaliação da FDA deve durar cerca de um mês e a concessão do registro de uso emergencial ainda em 2020.
Os testes clínicos da vacina envolvem cerca de 44 mil pessoas, sendo 3 mil no Brasil. Uma das exigências da FDA é que metade dos participantes do estudo tenha recebido o imunizante há pelo menos dois meses. A outra exigência é que ao menos 164 pessoas que participaram do estudo desenvolvam a doença, já que metade dos voluntários não foi imunizada.
A importância de aplicar placebo em metade dos participantes do estudo é comparar se o grupo vacinado de fato ficou protegido, já que se expôs à doença na mesma região e no mesmo período que os pacientes não imunizados. Quando divulgou os resultados preliminares no início desta semana, que apontaram eficácia de mais de 90%, o número de voluntários que desenvolveram covid-19 estava em 94.
Testes
A vacina em desenvolvimento pela Pfizer está em testes clínicos no Brasil desde julho e também precisará de registro na Anvisa (Agência Nacional de Vigilância Sanitária). Assim como a autoridade regulatória europeia, a Anvisa adotou um modelo de submissão contínua, em que os documentos exigidos para o registro começam a ser avaliados em etapas, antes da conclusão dos experimentos.
Segundo Murillo, a partir da conclusão dos testes de fase 3, ainda este mês, todos os documentos serão encaminhados para a Anvisa.
A empresa ainda negocia com o governo brasileiro a possibilidade de fornecer a vacina ao SUS (Sistema Único de Saúde). Diferentemente da CoronaVac — desenvolvida pelo Instituto Butantan em parceria com o laboratório chinês Sinovac — e da vacina de Oxford — desenvolvida pela AstraZeneca em parceria com a Universidade de Oxford —, o acordo não deve prever transferência de tecnologia em um primeiro momento, porque, segundo Murillo, a Pfizer e a Biontech optaram por concentrar a produção em suas plantas nos Estados Unidos e na Alemanha durante a pandemia.
"Na primeira etapa, a produção é centralizada. É a forma mais rápida de sair com a vacina. Passada a pandemia, a Pfizer vai avaliar e ver opções que permitam, como o Brasil, fazer a transferência de tecnologia".
Por ainda estar em negociação com o governo brasileiro, o executivo preferiu não revelar o preço da vacina, mas adiantou que há três faixas de preço oferecidas ao mercado global: uma para os países desenvolvidos, uma para os países de renda média, como o Brasil, e uma para os países mais pobres. Segundo Murillo, a Pfizer investiu US$ 2 bilhões (R$ 10,91 bilhões) de recursos próprios no desenvolvimento da vacina.
Refrigeração
A tecnologia inédita da vacina da Pfizer, de RNA mensageiro, traz um desafio para a logística: as doses precisam ser refrigeradas em freezers muito mais potentes que os disponíveis em postos de vacinação. Para contornar o problema, a farmacêutica tem trabalhado com parceiros para desenvolver uma embalagem especial que, apenas com gelo seco, consegue conservar a vacina a -70ºC por até 15 dias.
"Os avanços da ciência estão sendo vistos na parte da vacina e também na parte logística", disse Murillo, que já apresentou a embalagem ao governo brasileiro. "Não é um tema simples e tampouco resolve a logística, mas muda muito o esquema de pensar que um país precisaria, para cada centro de vacinação, ter um ultrafreezer".
A proposta da farmacêutica é negociar as embalagens junto com as vacinas, para que possam ser entregues dessa forma nos postos de vacinação. Depois da retirada dessa caixa, a vacina pode ficar em um refrigerador comum por até cinco dias.















ID: {{comments.info.id}}
URL: {{comments.info.url}}
Ocorreu um erro ao carregar os comentários.
Por favor, tente novamente mais tarde.
{{comments.total}} Comentário
{{comments.total}} Comentários
Seja o primeiro a comentar
Essa discussão está encerrada
Não é possivel enviar novos comentários.
Essa área é exclusiva para você, assinante, ler e comentar.
Só assinantes do UOL podem comentar
Ainda não é assinante? Assine já.
Se você já é assinante do UOL, faça seu login.
O autor da mensagem, e não o UOL, é o responsável pelo comentário. Reserve um tempo para ler as Regras de Uso para comentários.