Anvisa devolve pedido de uso emergencial de vacina Sputnik V a laboratório
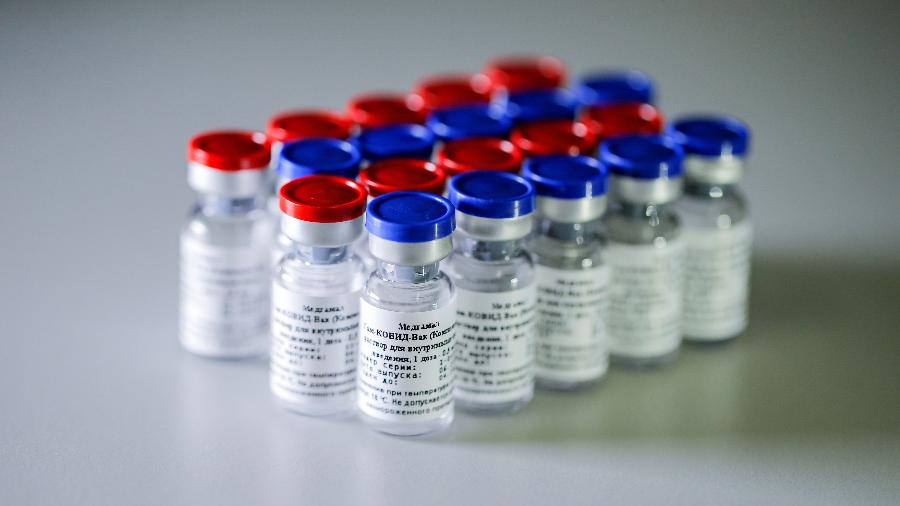
A Agência Nacional de Vigilância Sanitária (Anvisa) devolveu ao laboratório União Química os documentos referentes a pedido de uso emergencial no Brasil da vacina russa Sputnik V, alegando que não apresentam os requisitos mínimos para submissão e análise pelo órgão regulador.
Segundo nota no site da Anvisa, a Sputnik V ainda não recebeu autorização para realização dos ensaios clínicos de Fase 3 no Brasil, e uma das condições para se solicitar uso emergencial é a realização em andamento dos testes de estágio final no país. A Anvisa acrescentou que também há questões relativas às boas práticas de fabricação.
"A agência esclarece que não basta o pedido de autorização de estudo clínico de Fase 3 estar protocolado para pedir uso emergencial. É necessário que tais estudos estejam em andamento no país, além de outras medidas condicionantes já previstas", disse a Anvisa.
A União Química pediu aprovação de uso emergencial para o uso de 10 milhões de doses da Sputnik V no Brasil no primeiro trimestre deste ano.
O fundo soberano russo RDIF, que está promovendo a Sputnik globalmente, disse neste domingo que a Anvisa havia solicitado informações adicionais, que serão fornecidas em breve.
Em comunicado, o fundo afirmou que tais solicitações são um procedimento padrão e não significam que o pedido de registro tenha sido rejeitado. Afirmou ainda que legislação em tramitação no Congresso brasileiro, se aprovada, permitirá o uso de vacinas aprovadas por outros países.
A Rússia aprovou a Sputnik para uso na Rússia, embora os testes clínicos ainda não tenham sido concluídos.
O RDIF disse que a Sputnik já foi aprovada para uso também em Argentina, Bolívia, Argélia, Venezuela, Paraguai, Sérvia, Belarus e pelas autoridades palestinas. São esperados registros em mais dois países na próxima semana, acrescentou.
A Anvisa se reúne neste domingo para tomar uma decisão sobre pedidos de autorização do uso emergencial de vacinas desenvolvidas pela Sinovac, da China, e pela AstraZeneca, do Reino Unido.















ID: {{comments.info.id}}
URL: {{comments.info.url}}
Ocorreu um erro ao carregar os comentários.
Por favor, tente novamente mais tarde.
{{comments.total}} Comentário
{{comments.total}} Comentários
Seja o primeiro a comentar
Essa discussão está encerrada
Não é possivel enviar novos comentários.
Essa área é exclusiva para você, assinante, ler e comentar.
Só assinantes do UOL podem comentar
Ainda não é assinante? Assine já.
Se você já é assinante do UOL, faça seu login.
O autor da mensagem, e não o UOL, é o responsável pelo comentário. Reserve um tempo para ler as Regras de Uso para comentários.