Anvisa diz que avaliará vacinas em 10 dias e registro estrangeiro não basta
A Anvisa (Agência Nacional de Vigilância Sanitária) afirmou hoje que os pedidos de uso emergencial das vacinas contra o novo coronavírus que chegarem até o órgão terão sua avaliação concluída em até dez dias após a solicitação. Em nota, a agência ainda disse que apenas vacinas com testes clínicos conduzidos no Brasil poderão receber a aprovação emergencial.
No comunicado, a Anvisa afirmou também que o simples registro emergencial por órgãos de outros países não bastará para replicar a aprovação no Brasil.
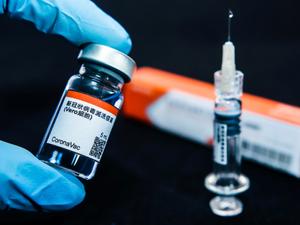
Hoje, o governo de São Paulo anunciou que pedirá o registro definitivo e o emergencial da CoronaVac —produzida pelo laboratório chinês Sinovac e pelo Instituto Butantan— ao mesmo tempo e que conta com a aprovação da agência local na China para abreviar o registro no Brasil.
Até agora, não havia prazo estabelecido para avaliação de pedidos de uso emergencial de vacinas, mas a agência já esperava se manifestar antes dos 60 dias previstos para avaliação de registro de produtos contra a covid-19.
Uma vez que todos os documentos necessários tenham sido submetidos à Anvisa pelos fabricantes da vacina, a Anvisa estima que o prazo de 10 (dez) dias seja adequado para concluir a avaliação quanto à autorização de uso emergencial, desde que sejam vacinas das empresas que venham apresentando dados para a Agência e possuam ensaios clínicos em andamento no Brasil.
Anvisa
A agência disse que seus servidores estão trabalhando em tempo integral, inclusive nas semanas de Natal e Ano-Novo, para avaliar os procedimentos relacionados a vacinas.
"Neste momento de grande urgência, reafirmamos o nosso compromisso com à (sic) saúde pública e atuação célere para fins de disponibilizar a nossa população uma vacina Covid 19, conforme os parâmetros de qualidade, eficácia e segurança."
Registro no exterior não basta
Sobre a possível facilitação de aprovação de vacinas já liberadas emergencialmente por órgãos reguladores no exterior, a Anvisa afirmou que não há previsão de que isso ocorra. Segundo a agência, cada país tem suas peculiaridades que devem ser observadas na avaliação dos imunizantes.
Parte dos dados, bem como compromissos e planos de monitoramento que precisam compor o pedido de uso emergencial se referem exclusivamente a realidades nacionais e, por isso, a importância da análise da vacina a ser usada no Brasil, vir a ser realizada pela Anvisa.
Anvisa
A agência também disse que possui acordos com "as principais autoridades reguladoras estrangeiras" e que há procedimentos que permitem que algumas informações já avaliadas por outras agências tenham análise mais rápida pela Anvisa. No entanto, frisou que em nenhum dos acordos há a previsão de que os órgãos enviem dados das vacinas diretamente à Anvisa, cabendo aos laboratórios fazerem isto.
"Acompanhando o cenário mundial, é possível perceber que nenhuma autoridade reguladora, até o momento, concedeu autorização de uso emergencial de forma automática, baseada na avaliação de um outro país", afirmou.
Segundo lei aprovada no início da pandemia, a Anvisa tem 72 horas para avaliar um pedido de uso de vacina baseado no registro de uma agência estrangeira. No entanto, na nota oficial divulgada hoje, o único prazo mencionado pela Anvisa são os dez dias para autorização de uso emergencial.
Segundo esta lei, a Anvisa tem prazo de 72 horas para que analise medicamentos contra covid-19, desde que tenha registro para uso permanente da agência americana, europeia, japonesa ou chinesa.
Segundo a Anvisa, no caso das vacinações que acontecem no Reino Unido e nos Estados Unidos, por exemplo, as autorizações são para vacinação emergencial e não para registro da vacina. O registro acontece quando as pesquisas são finalizadas e as agências de saúde permitem a venda comercial das vacinas em clínicas particulares, com bula e aplicação em massa.
Anvisa questiona padrões da China
Especificamente sobre a CoronaVac, a Anvisa, em sua nota oficial, colocou em dúvida os padrões adotados pela agência reguladora chinesa. O país oriental já vacina emergencialmente seus cidadãos desde junho, mas usou para isso dados parciais de eficácia divulgados pelo laboratório Sinovac. O relatório final do imunizante só deve ficar pronto na semana que vem.
"Os critérios chineses para concessão de autorização de uso emergencial na China não são transparentes e não há informações disponíveis sobre os critérios atualmente empregados pelos órgãos chineses para essa tomada de decisão. Até o momento, nenhuma outra autoridade reguladora estrangeira tomou decisão semelhante em seus países", diz a Anvisa.
Sem citar diretamente o governo de São Paulo, a agência diz que replicar a autorização concedida pela agência chinesa poderia trazer riscos aos brasileiros, embora não tenha informado quais.
Caso venha a ser autorizada a replicação automática da AUE (Autorização de Uso Emergencial) estrangeira no Brasil, sem a devida submissão de dados à Anvisa, são esperados enfraquecimento e retardação na condução do estudo clínico no Brasil; além de expor a população brasileira a riscos que não serão monitorados pela empresa desenvolvedora da vacina
Anvisa, sobre aprovação chinesa da CoronaVac
Nenhuma vacina pediu autorização no Brasil
Até agora, nenhum fabricante pediu a aprovação emergencial de alguma vacina para a Anvisa. Havia a previsão de que a primeira a ter o seu pedido requisitado fosse a CoronaVac, porém, devido a uma mudança de estratégia, o imunizante terá seu registro definitivo solicitado na semana que vem.
Há quatro vacinas com testes de fase 3 em andamento no Brasil: a desenvolvida pela AstraZeneca em parceria com a Universidade Oxford, a da Sinovac em parceria com o Instituto Butantan, a das americanas Pfizer e BioNTech e a vacina da Janssen-Cilag (Johnson & Johnson).
* Com informações de Estadão Conteúdo
















ID: {{comments.info.id}}
URL: {{comments.info.url}}
Ocorreu um erro ao carregar os comentários.
Por favor, tente novamente mais tarde.
{{comments.total}} Comentário
{{comments.total}} Comentários
Seja o primeiro a comentar
Essa discussão está encerrada
Não é possivel enviar novos comentários.
Essa área é exclusiva para você, assinante, ler e comentar.
Só assinantes do UOL podem comentar
Ainda não é assinante? Assine já.
Se você já é assinante do UOL, faça seu login.
O autor da mensagem, e não o UOL, é o responsável pelo comentário. Reserve um tempo para ler as Regras de Uso para comentários.